Proprietățile chimice și producția industrială - Acid sulfuric
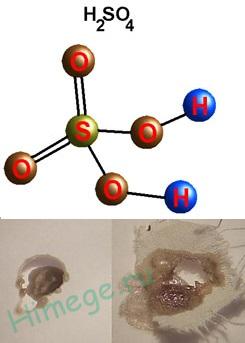
Grele lichid uleios ( „ulei de vitriol“);
densitate 1,84 g / cm3; nevolatilă, foarte solubil în apă - cu o căldură puternică; t ° mp. = ° C 10,3, t ° încălzit. = 296 ° C, foarte higroscopică, ea are proprietăți deshidratant (carbonizarea hârtie, lemn, zahăr).
Căldura de hidratare este atât de mare încât amestecul poate fierbe, pulverizat și provoca arsuri. Prin urmare, este necesar să se adauge acidul în apă, dar nu și invers, deoarece adăugarea de apă la o apă acidă ar fi mai ușor pentru suprafața de acid în cazul în care se concentrează toată căldura eliberată.

Producția industrială de acid sulfuric (metoda de contact):
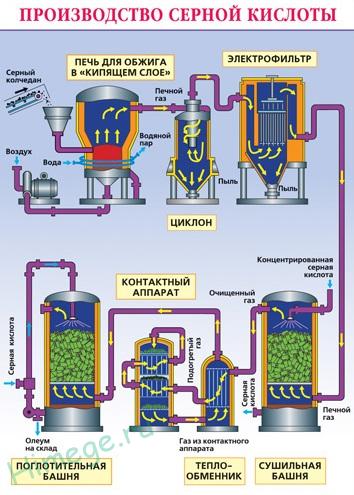
Măcinat pirita umed purificat (pirită) de mai sus se toarnă în cuptor în „patul fluidizat“. Bottom (principiul contracurent) trecerea aerului, îmbogățit cu oxigen.
Din cuptorul iese gaz de furnal, a cărui compoziție este: SO2. O2. vapori de apă (pirita era umedă) și particule fine calcinat (oxid de fier). Gazul purificat de particule de impurități solide (în ciclon și electrostatice) și vapori de apă (într-un turn de uscare).
Aparatul de contact de dioxid de sulf este oxidat folosind un catalizator V 2 O 5 (pentoxid de vanadiu), pentru a crește viteza de reacție. Oxidarea un oxid la celălalt este reversibil. Prin urmare, condițiile optime sunt selectate flux de reacție directă - presiune ridicată (deoarece reacția are loc direct cu reducerea volumului total) și temperatura nu este peste 500 C (deoarece reacția este exotermă).
În turnul de absorbție are loc absorbția oxidului de sulf (VI) cu acid sulfuric concentrat.
absorbție a apei nu este utilizat, deoarece oxidul de sulf se dizolvă în apă pentru a elibera cantități mari de căldură, astfel încât acidul sulfuric format fierbe și se transformă în abur. Pentru a evita formarea ceții de acid sulfuric utilizat -ing acid sulfuric concentrat 98%. oxid de sulf este foarte solubil în astfel de formă de acid oleum: H2 SO4 · nSO3
Proprietățile chimice ale acidului sulfuric:
H2 SO4 - acidul dibazic puternic, unul dintre cei mai puternici acizi minerali, datorită legăturii de înaltă polaritate H - O ușor de rupt.
1) Într-o soluție apoasă de disociază de acid sulfuric. formând un ion de hidrogen și un rest de acid:
H2 SO4 = H + + HSO4 -;
HSO4 - = H + + SO4 2-.
Ecuația generală:
H2 SO4 = 2H + + SO4 2-.
2) Reacția acidului sulfuric cu metale:
Acid sulfuric diluat se dizolvă numai metale în picioare în seria electrochimică stânga hidrogenului:
Zn 0 + H2 SO4 +1 (diluat) → Zn + 2 + H2 SO4
5) Reacția de schimb cu săruri:
BaCl2 + H2 SO4 → BaSO4 ↓ + 2HCl
Formarea de precipitat alb BaSO4 (insolubilă în acid) utilizat pentru detectarea acidului sulfuric și sulfații solubili (reacție de calitate pentru ion sulfat).
Proprietățile speciale ale SO4 H2 concentrate:
1) Acid sulfuric concentrat este un oxidant puternic; prin reacția cu metale (cu excepția Au, Pt) pentru a recupera S 4 O2. S 0 sau H2 S -2 în funcție de activitatea metalică. Fără încălzire nu reacționează cu Fe, Al, Cr - pasivare. Cand interactioneaza cu metale având ultimul valența variabilă sunt oxidați la stările de oxidare superioare. decât este cazul cu o soluție diluată de acid: Fe 0 → Fe 3+. 0 Cr → Cr 3+. 0 Mn 4+ → Mn, Sn → Sn 4+ 0
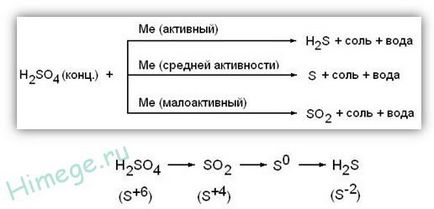
Metal moderat activ
2) Acid sulfuric concentrat oxidează unele nemetale tind să maximizeze oxidarea se recupereaza DdS + 4O2:
3) Oxidarea substanțelor complexe:
Acidul sulfuric oxidează HBr și HI pentru halogeni liberi:
KBr 2 + 2H2 SO4 = K2 SO4 + SO2 + Br2 + 2H2O
2 KI + 2H2 SO4 = K2 SO4 + SO2 + I2 + 2H2O
Acid sulfuric concentrat nu se poate oxida ion clorură la clor liber, care permite producerea de HCl prin reacția de schimb:
NaCl + H2 SO4 (conc.) HCI + = NaNSO4
Acidul sulfuric legat chimic consumatoare de apă din compușii organici care conțin grupări hidroxil. Deshidratarea etanol, în prezență de acid sulfuric concentrat conduce la prepararea etilenei:
C2 H5 OH = C2 H4 + H2 O.
. Cementizare de zahăr, celuloză, amidon și alți carbohidrați în contact cu acidul sulfuric se datorează și deshidratare:
C6 H12 O6 + 12H2 SO4 = 18H2 O + 12SO2 ↑ + 6CO2 ↑.
