Cum se calculează masa atomică
Greutatea atomică este suma maselor de protoni, neutroni și electroni, care constă dintr-un anumit atom sau moleculă. [1] Comparativ cu protoni și neutroni, electroni masa este foarte mică, de aceea, nu este luată în considerare în calcule. [2] Deși este corect din punct de vedere formal, acest termen este folosit adesea pentru a se referi la masa atomică medie a tuturor izotopii unui element. De fapt, este masa atomică relativă, de asemenea, numit greutatea atomică a unui element. [3] greutate atomică - masa atomică medie a tuturor izotopii unui element care apar în natură. Chimiștii trebuie să se facă distincția între aceste două tipuri de masă atomică la efectuarea lucrărilor - masa atomică valoare greșită poate, de exemplu, să conducă la un rezultat incorect pentru randamentul reacției.
pași Editare
Metoda 1 de la 3:
Găsirea masa atomică a tabelului periodic al elementelor Editare


- Unitatea de masă atomică caracterizează masa molară a elementului în grame. Această valoare este foarte utilă în calcule practice, deoarece aceasta poate ajuta să transfere cu ușurință o cantitate predeterminată de masă de atomi sau molecule ale substanței în moli, și vice-versa.


- Rețineți că toate masele atomice relative enumerate în tabelul periodic, pentru fiecare element sunt valori medii. In elementele chimice au diferite izotopi - variante chimice cu diferite mase datorate neutronii suplimentare sau care lipsesc în nucleul atomic. [5] Prin urmare, masele atomice relative enumerate în tabelul periodic poate fi utilizată ca valoare medie pentru atomii unui element specific, dar nu din masa unui atom al elementului.
- Masa atomică relativă conținută în tabelul periodic, utilizate pentru a calcula masele molare de atomi și molecule. masa atomică, exprimată în uam (Ca și în Tabelul Periodic) este în mod substanțial adimensională. Cu toate acestea, pur și simplu prin multiplicarea greutății atomice a 1 g / mol, obținem un element caracteristic util - masa (în grame) pe atomi molari de acest element.


- Deoarece greutatea atomică medie este o valoare medie pentru mai mulți izotopi, valoarea specificată în tabelul periodic nu este valoarea exactă a oricăror unice atomi atomice de masă.
- Masa atomică a atomilor individuali se calculează ținând cont de numărul exact de protoni și neutroni într-un singur atom.
Metoda 2 din 3:
Calcularea masei atomice a unui singur atom Edit
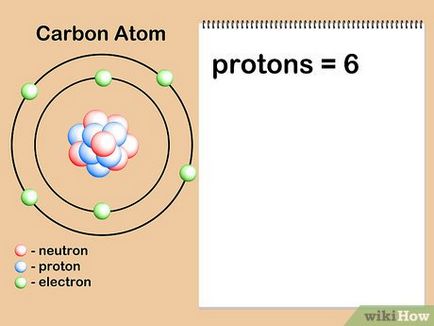

- Să presupunem că suntem atom de carbon interesat. Atomii de carbon sunt întotdeauna șase protoni, deci știm că numărul său atomic este 6. În plus, vom vedea că există numărul „6“ din tabelul periodic, în partea superioară a celulei cu carbon (C), indicând faptul că atomic numărul atomilor de carbon este egal cu șase.
- Rețineți că numărul atomic al elementului nu este legată în mod unic cu masa atomică relativă în sistemul periodic. Deși, în special pentru elementele din partea de sus a tabelului, poate părea că masa atomică a elementului de două ori numărul său atomic, niciodată nu va fi calculată prin înmulțirea numărului atomic de două.
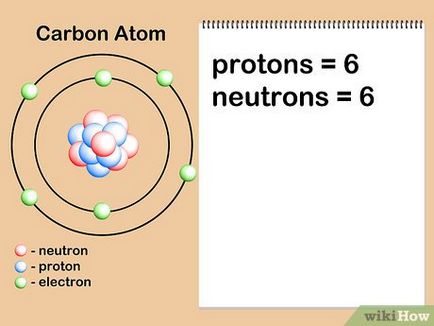

- Numărul de neutroni poate fi determinat prin marcarea elementului izotop. De exemplu, carbon-14 este un izotop radioactiv de carbon-12, găsit în natură. Deseori, numărul de izotopi este indicat ca numere superscript, în picioare în fața elementului simbol 14 C. Cantitatea de neutroni se obține prin scăderea numărului de protoni din camera izotopului: 14 - 6 = 8 neutroni.
- Să presupunem că suntem atom de carbon interesat are șase neutroni (12 C). Acesta este cel mai frecvent izotopul de carbon, cu aproximativ 99% din atomii unui element dat. [7] Cu toate acestea, aproximativ 1% din atomi de carbon au 7 neutroni (13 C). Alte tipuri de atomi de carbon sunt mai mari de 7 sau mai mic de 6 neutroni și există în cantități foarte mici.
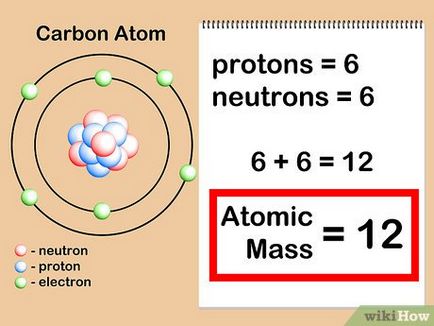

- atom de carbon are 6 protoni + 6 neutroni = 12. Astfel, greutatea atomică a carbonului este egală cu 12. Dacă era izotopul „carbon-13“, atunci vom ști că el are 6 protoni + 7 = neutroni nucleare masă 13.
- De fapt, masa atomică a carbonului-13 este 13.003355 [8]. iar această valoare este mai precisă, deoarece a fost determinată prin experimentare.
- Masa atomică este foarte aproape de numărul de izotopului. Pentru ușurința de calcul al numărului de izotopi este adesea egală cu masa atomică. Valoarea determinată experimental a masa atomică a izotopului ușor depășește numărul contribuției foarte mici de electroni.
Cum se determina gradul de oxidare


Cum de a găsi numărul de protoni, neutroni și electroni

Cum se calculează concentrația soluției

Cum sa faci gheata uscata


Cum se utilizează tabelul periodic


Cum pot stoca gheata uscata

Cum acidifierea solului


Cum de a calcula molaritatea soluției


Ca amoniac Neutralizare


Cum să treci examenul în chimie