Periodic Legea etc.


Un grup de elemente este o secvență pe verticală a elementelor chimice în sistemul periodic. Fiecare grup are două subgrupuri: principale și laterale. Elementele primelor trei perioade se aplică numai la principalele subgrupe. Printre principalele subgrupe sunt, de asemenea, elementele de perioade lungi (de la a patra), care sunt situate pe aceeași parte a celulei, precum și elemente ale primelor trei perioade. De exemplu, un element chimic de potasiu (K) pentru a patra perioadă a primului grup apartine subgrupei principal, și cupru (Cu), situate în aceeași perioadă și același grup - lateral.
Să considerăm doi atomi: un atom de hidrogen și un atom de litiu (Li). Ambii atomi sunt în același grup (I) și au fiecare un electron într-un strat electronic extern. Diferența este că electronul exterior al atomului de hidrogen este pe primul strat de electroni, în timp ce litiu - al doilea. Evident, dimensiunea atomilor de litiu decât atomii de hidrogen (Fig. 3.3).
Fig. 3.3. Comparând dimensiunile atomilor de hidrogen ai litiului și aranjate în același grup
„Proprietățile elementelor, și, prin urmare, ele formează obiecte simple și complexe (substanțe), sunt în dependență periodică de greutatea atomică.“
„Proprietățile elementelor chimice (adică, proprietățile și forma compușilor formați de aceștia) sunt responsabile periodic, în funcție de nucleul atomilor de elemente chimice.“
Sensul fizic al periodicității chimice
Schimbările periodice ale proprietăților elementelor chimice cauzate de repetarea cea mai bună configurație a nivelului extern electronic de energie (valență de electroni) a atomilor lor cu creșteri de sarcină nucleară.
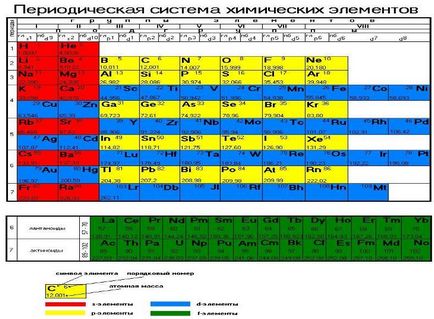
Reprezentarea grafică a legii periodice este un tabel periodic. Conține perioade de 7 și 8 grupe.
Perioada - rânduri orizontale de elemente cu aceeași valoare maximă a numărului cuantic principal de electroni de valență.
Numărul perioadei reprezintă numărul de nivele de energie din atomii unui element.
Perioadele pot consta din două (mai întâi), 8 (a doua și a treia), elementele 32 (a șasea) 18 (a patra și a cincea) sau, în funcție de numărul de electroni în nivelurile de energie exterioare. În sfârșit, perioada a șaptea este incompletă.
Toate perioadele (cu excepția primului) pornind de metal alcalin (s - Element), și se termină cu gaz nobil (ns 2 np 6).
Proprietățile de metal sunt considerate atomi elemente capacitatea de a dona cu ușurință electroni, și nemetalice - atașarea electronilor din atomii din dorința de a dobândi o configurație stabilă cu subnivele umplut. Umplerea s externe - indică proprietăți metalice subnivel atom și care formează un p extern - subnivel - pe proprietățile metalice. Creșterea numărului de electroni pe p - subnivel (1 la 5) îmbunătățește proprietățile atomilor nemetalice. Atomii cu format complet configurație stabilă energetic exterior strat electronic (ns 2 np 6) este chimic inert.
In perioade mari de tranziție de proprietățile metalului activ la gazul nobil are loc mai lin decât în perioadele mici, deoarece Este formarea internă (n - 1) d - menținând în același timp ns subnivel extern 2 - strat. perioade mari constau din rândurile pare și impare.
În elemente ale chiar rândurile din stratul exterior 2 ns - electroni, de aceea predomină proprietățile metalice și de atenuare a acestora, cu o creștere a taxei nucleare este scăzută; în rânduri impare formate np - subnivel, ceea ce explică deprecierea semnificativă a proprietăților metalice.
Grupurile - coloane verticale ale elementelor cu același număr de electroni de valență egal cu numărul de grup. Se face deosebirea între subgrupe principale și secundare.
Elementele Root subgrupului constau din perioade mici și mari valență electroni care sunt situate pe ns exterioare - și np - subnivele.
subgrupe secundare sunt formate din elemente numai pe perioade mari. electronii de valență sunt pe ns exterioare - subnivel interior și (n - 1) d - subnivel (sau (n - 2) f - subnivel).
În funcție de ce sub-strat (uri -, p -, d - și f -) electroni de valență umplute cu elementele sistemului periodic sunt împărțite în: s - elemente (elemente din grupa principala I și grupele II), p - elemente (elemente din grupa principală III - VII grupe), d - elemente (elemente secundare ale subgrupe), f - elemente (lantanidelor, actinide).
Principalele Subgrupurile de sus în proprietățile metalelor inferioare sunt intensificate, și nemetalice slăbi. Elementele principale și secundare grupuri sunt foarte diferite în proprietățile lor.
Numărul grupului indică un element de valență mai mare (cu excepția O. F. elemente subgrupurilor de cupru și grupe a opta).
Elementele comune principale și subgrupurile cu formula sunt oxizi superiori (și hidrații acestora). In oxizi mai mari și hidrații lor elemente I - grupa III (cu excepția bor) sunt dominate de proprietățile de bază ale IV cu VIII - acidul.
Pentru elementele subgrupe principale comune sunt compușii cu formula de hidrogen. Elementele principale I grupa - grupele III forma solide - hidruri (oxidarea hidrogenului - 1) și IV - VII grupe - gazoase. Compușii cu hidrogen subgrupurilor IV elemente principale de grup (EN 4) - neutru, grupa V (EN 3) - bază, VI și VII grupări (H 2 Oe și NE) - acid.
Din poziția elementelor din proprietățile dependente ale sistemului periodic al atomului conectat la configurația electronică: raza atomica - de la stânga la dreapta scade pe parcursul perioadei, iar într-un subgrup crește în jos; energia de ionizare - creșterile perioadei și scăderile în subsetul; electronegativitate - crește perioada de și scade în subgrupul.
Poziția elementului în sistemul periodic poate prezice proprietățile sale de bază ca media tuturor vecinilor săi:
caracterizează elementele chimice pe baza tabelului periodic cu număr atomic 21 și 34.
Pentru a caracteriza elementele chimice ale sistemului periodic Mendeleev ar trebui să fie luate în considerare:
Poziția în tabelul periodic (numărul de ordine, rând perioadă, grup, subgrup; masa atomică).
Structura atomică (miez de încărcare; compoziția de bază - numărul de protoni p 1 1 0 1 n neutroni și electroni # 275 ;; numărul de nivele de energie și subnivele; scrie formula configurația electronică; celulă cuantică; numărul și natura electronilor de valență determina tipul elementului).
Formulele și natura chimică a compușilor (oxid superior și hidroxid; compuși de hidrogen).
Comparați cu vecinii (pentru perioada, potrivit grupului).
Numărul de ordine al elementului Z = 21 reprezintă elementul de încărcare nucleului atomic (Sc): 65 21 Sc - +21; numărul de protoni p 1 1. 21 Sc - 21 1 p 1; numărul de electroni # 275;: 21 Sc - 21 # 275 ;; numărul de neutroni n 1 0 = A r - Z = 65 - 21 = 44 - 1 0 44 n
Structura Formula atomului
Scandiu este o perioadă IV; perioadă, numărul indică numărul de nivele de energie - 4.
Scandiu este situat în sub-grupuri. Prin urmare, electronii de valență sunt depozitate la 4 s - și 3 d - subnivele.
E formula scandiu
Scandiu - d - elementul. Structura electronică a atomului termină s - electroni, astfel încât elementul va prezenta proprietăți metalice.
Formula oxid superior - Sc 2 O 3. hidroxid - Sc (OH) 3 au proprietăți bazice slabe. Compușii cu hidrogen nu formează.
B) Numărul de ordine 34 are o seleniu Se. elementul IV este în perioada, are mijloace 4 nivele energetice atom. Acesta este situat în subgrupul principal al Grupului VI; electronii de valență sunt distribuite în 4 s 4 și p - subniveluri.
formula E-seleniu:
34 1s de Se 2s 2 2 2 2p 6 3s 3p 6 3d 10 4s 2 4p 4
Stratul exterior sub forma de celule cuantice este următoarea:
atom seleniu are șase electroni de valență; astfel încât valența superioară egală cu 6, care corespunde numărului grupului.
Seleniu - p - element va fi, prin urmare proprietăți nemetalici.
3. oxid superior sEo hidroxidul de H 2 SeO 4 și compus hidrogen gazos H 2 Se au caracter acid.
Legea periodică și sistemul periodic al elementelor chimice DI Mendeleev. Razele atomilor și variațiile lor periodice în sistemul de elemente chimice. Legile proprietăților chimice ale elementelor și conexiunile acestora la perioade și grupuri.
legea periodică a fost descoperit D. I. Mendeleevym în 1869. Aici este o formulare modernă a lui „proprietăți ale elementelor chimice și compușii lor sunt în dependență periodică cu privire la taxa de nucleele atomilor.“ Acest lucru înseamnă că, dacă plasați elementele chimice în ordine crescătoare a nucleului, proprietățile lor va fi mai întâi să se schimbe treptat, și apoi câteva elemente ale acestor modificări vor fi repetate.
Motivul acestor modificări este structura electronică a atomilor. Atom aranjate astfel încât electronii acestuia să nu fie aranjate la întâmplare, ci în straturi. In primul strat doar două electroni proprietăți chimice de aici prin elementul repetat 2 (Fig. 3.1.). In al doilea strat de electroni poate găzdui 8 electroni, proprietăți chimice, astfel se repetă după 8 elemente. relație suplimentară între numărul maxim de electroni la nivelul proprietăților repetabilitate și chimice ale elementelor devin mai complexe, dar proprietățile elementelor chimice este de asemenea repetate.