Tabelul periodic al elementelor, etc.
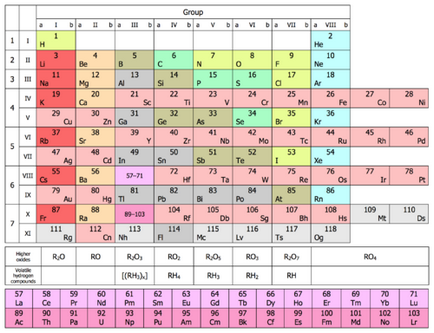
Grupurile menționate coloanele verticale ale sistemului periodic al elementelor chimice. Versiunea scurtă a tabelului este izolat opt grupuri. Numărul de grup este aceeași ca cea mai mare valența unui element chimic, pe care îl poate exercita în oxizi. Astfel, carbon, în timp ce în grupa IV prezintă cea mai mare valență IV (CO2) în combinație cu oxigenul. Calciul același Valentin II (CaO), deoarece acesta se află în al doilea grup.
Versiunea scurtă a tabelului fiecare grup este împărțit în două sub-grupuri - principal și lateral. În subgrupurile constă din numai elementele perioade lungi - metale de tranziție.
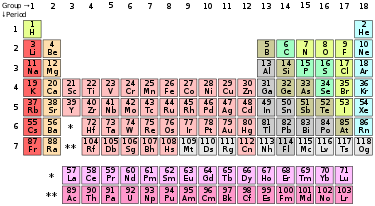
În versiunea lungă a sistemului periodic au subgrupuri și numărul de grupuri este egal cu 18.
Versiunea scurtă a tabelului reprezintă grupa cifre romane și litere subgrupa A (major) și B (o parte). Într-o variantă lungă sunt notate cu cifre arabe.
În subgrupuri (având în vedere versiunea scurtă) elemente au proprietăți chimice similare. De exemplu, elementele subgrupul IA - este un metal alcalin, și VIIA subgrupă - halogeni. După cum se știe, toate metalele alcaline au proprietăți similare, halogeni sunt similare între ele. Cu toate acestea, proprietățile subgrupurile elementelor variază în mod regulat în jos (cu creșterea masei atomice relative). Principalele subgrupe în creștere în jos substanțe simple, din metal proprietăți ale elementelor chimice corespunzătoare. Proprietățile metalice, respectiv scădere. Astfel, într-un bor subgrupă IIIA (B) nu este metalic și dispusă sub a treia etapă din aluminiu (Al) deja este un metal. Următoarele principale subgrupe - IVA - nemetale sunt carbon, siliciu și germaniu, dar situate sub staniu și plumb - metale.
În diferite subgrupuri de un grup diferă în proprietățile elementelor. Cu toate acestea, ele au aceeași valență cea mai mare egal cu numărul de grup.